
Lacerta Tokyo Сo.,Ltd.
新製品-新技術開発のための積極的なオープンイノベ
ーションを目指しています,
開業医および顧客の必要性を満たすこと。

PDRN

ペプチド

ボツリヌス毒素A型
PDRNは確かに本当の感覚です。 それらは、外的要因によって内側から損傷した皮膚の構造を回復させ、内部からの年齢およびホルモンの変化を回復させ、タンパク質の産生を刺激す これらは根本的に新しいユニークな技術であり、pdrに基づいており、兆候ではなく、老化の原因と戦うことができます。 医学、美容学では、PDRNは、細胞に有糸分裂性デオキシリボヌクレオチド、窒素塩基およびデオキシリボヌクレオシドを十分な量で供給する”プロドラッグ”と ポリヌクレオチドの有効性DNA-RNA複合体に薬物を使用する可能性は、前臨床試験の段階で審美医学のin vitro試験系の枠組みで研究された。 研究のために選択された試験系は、ヒト表皮細胞の培養物であった。 結果が得られた:
DNAおよび細胞内タンパク質の合成速度は、1.5倍から2倍に増加した;
効果の重症度は、複合体の濃度に直接依存していた。
したがって、PDRNが細胞代謝に及ぼす影響のメカニズムが証明されました。 顕著な刺激効果は、体の全体的な免疫に対する表皮の免疫担当細胞の作用のために明らかにされた。 したがって、局所的な刺激だけでなく、ポリヌクレオチドの作用によるヒト免疫系の強化についても結論づけられた。
ペプチドは、分子が2つ以上のアミノ酸から構築されている物質のファミリーです。 ペプチドには、すべての既知のホルモンとほとんどの酵素の約半分が含まれています。 しかし、特別なクラスの化合物—ペプチド生体調節剤もあります。 それらは、タンパク質合成を誘発する能力において他のペプチドとは異なる。
ペプチッドbioregulatorsは顕著な老年学者、教授、MD V.H.Havinsonによって70年代に発見されました。 したがって、それらはHavinsonペプチドと呼ばれます。
Havinsonペプチドは細胞内でどこから来るのですか
細胞内で合成されたタンパク質はその仕事をし、その後それは破壊されます。 ペプチダーゼ酵素の助けを借りて、それは断片に「切断」されます。 それらのいくつかは排泄システムを通して体を離れます。 そして、他の部分は断片化されています。 いくつかのタンパク質断片には、特定の方法で接続されたアミノ酸のセグメントが含まれています。 これらは、Havinsonが発見したペプチド生物調節剤です。
生物調節剤は厳密にDNA分子の特定の部分に対応する。 それはドアを開けるために磁気ロックに信号を与える磁気キーのようなこの区域に地図を描かれる。 DNA分子が巻き戻され、そこから情報が読み取られ、チートシートマトリックス(RNA)が構築され、それに従ってタンパク質が合成されます-前に処分されたもの。 したがって、生体調節ペプチドはタンパク質から形成されるが、それらがなければ同じタンパク質の合成は不可能である。
なぜペプチド生体調節剤を服用する必要があるのですか
理想的な状態であっても、健康な体は、内部埋蔵量の助けを借りて、ペプチドの欠乏をわずか90%補い、残りの10%を食物と
一緒に受け取ります。この問題は, ストレス要因が体に作用し始める瞬間に始まります:
-座りがちな仕事;
-ムッとした部屋;
-不適切な栄養;
-生態系が悪い,
-その他
彼らの影響下で、臓器や組織は徐々に摩耗し、もはや食物と一緒に来る十分なペプチドを持っていません。 この場合、ペプチド薬が救助に来て、これは一時的にこの欠乏を補う。
将来的には、組織が適切な量の必要なタンパク質を産生すると、その機能は正常化する。 しかし、体が以前と同じようにストレス負荷にさらされると、臓器や組織の働きが再び失敗し、再びサポートが必要になります。
Havinsonペプチドがどのように機能し、どのようにそれらを取るか:私たちは簡単な言葉であなたに伝えます
生物調節剤は、それらが単離された器官のみに影響を及ぼす。 たとえば、Endolutenは骨端に作用し、Visolutenは目に作用します。 したがって、医師は、組成物中の異なるペプチドを有するいくつかの薬物のコースを処方することができる。 しかし、専門家は同時に5つ以上の生体調節剤を服用することをお勧めしません。
まず第一に、ストレスへの適応のメカニズムに影響を与え、解毒システムを整える必要があります。 したがって、神経内分泌系、免疫系、血管系および神経系を回復させ、肝臓、軟骨、血管などの局所ペプチドの助けを借りて他の系および器官の働きを正常化するための薬物による治療を開始することをお勧めします。
ペプチド薬は累積的な効果を持っています—その後の各コースは前のコースよりも効果的です。 ペプチドの1〜3ヶ月のコースの後、彼らはさらに6ヶ月間行動します。 したがって、臓器の働きを適切なレベルに維持するために、1年に2つのコースのペプチド生体調節剤を服用することをお勧めします。
ペプチド生体調節剤は、互いに互換性があるだけでなく、伝統的な薬とも互換性があります。 彼らのレセプションのおかげで、主な治療薬の投与量を最小限に抑えることが可能です–もちろん、主治医との検査と相談の後。
適応
それは20の年齢から始まるすべての人々のためのペプチッドbioregulatorsを取ることは理にかなっています。 彼らはまた、ストレスが増し、環境条件が悪い状態で生活したり働いたりする人々、すなわち大都市の住民、工業企業の従業員、オフィス従業員によっても
ペプチド生体調節剤の種類と分類
38のペプチッドbioregulatorsがあります: すべての哺乳動物が同じペプチド生物調節剤を有するので、天然動物原料が製造に使用される。 17人工-それらは植物から単離されたアミノ酸から作られています。 人工ペプチド生体調節剤は、抽出物に含まれる主ペプチドの短縮コピーである。 それらの効果は自然なものほど長続きしませんが、それはより速く達成されます。 これは、分子が短く、それらの濃度がはるかに高いためです。 Havinson教授によると、人工ペプチドは、人類が自然のものが不足していると感じるときに不可欠になるでしょう。
ペプチド生体調節剤を用いた調製物は、3つのグループに分けることができる:
Cytomaxは天然のHavinsonペプチドです。 各臓器のカプセルには別の薬があります。 それらのいくつかは、舌の下の滴の形をしています—一連の「舌」。 外用のために、溶液中にペプチド複合体も存在する。 そのような各複合体は、特定の群の器官のためのペプチドを含む。
サイトジェンはカプセルに入った人工的なハビンソンのペプチドである。 各調製物は、1つの特定の器官のためのペプチドを含む。
Revilab-異なる臓器の最大4つの人工ペプチドを含むペプチド複合体。 Revilab SL—舌の下に滴り、Revilab ML—カプセルの2つのタイプがあります。
中枢神経系および脳の修復のためのペプチド
Havinsonペプチドは特に成人期に関連しています。 臨床的に証明されています:バイオレギュレーターは、ニューラルネットワークを刺激するいわゆるスパイクを復元します。 したがって、それらを服用することは平均余命を延ばすだけでなく、アルツハイマー病、パーキンソン病などの神経変性疾患の発症を防ぎます。
ペプチドについて知っておくべき他に重要なこと:よくある質問への回答
ペプチド生体調節剤を経口摂取できるのはなぜですか? 彼らは胃の中で破壊されていませんか?
Havinsonペプチドは、胃腸管に吸収されたときにその構造を維持することができる。 これは、それらが非常に短いという事実のために可能である:それらの長さは20アミノ酸以下であり、活性部位は2〜3アミノ酸のみからなる。 このような小さな構造は、消化器系で崩壊せず、細胞膜に容易に浸透する。 カプセル中の薬物の有効性は、注射よりもはるかに便利であることに加えて、臨床研究によって確認されている。
私は複数のペプチッド薬物を同時に取ってもいいですか?
ペプチドは標的化された方法で作用するので、いくつかの薬物を同時に使用することができる。 それらは互いに互換性があり、互いに干渉せず、薬用薬を含む他の薬と組み合わされます。 例外:Glandokort(副腎ペプチド)とEndoluten(骨端ペプチド)を同時に服用することはお勧めしません。
ペプチッドbioregulatorsを取ることを止めれば何が起こりますか。 離脱症候群はありますか?
ペプチドはDNAを活性化し、それによって細胞内のタンパク質合成を誘発しますが、これはすでに起こっていますが、ストレスやペプチド欠乏症のために十分に積極的ではありません。 したがって、離脱症候群はなく、起こりうる最悪の事態は、追加のペプチドが消失した後、細胞が以前のレベルの合成に戻ることです。 しかし、練習が示すように、それは最初のものよりも高くなります。 Havinsonペプチドはホルモンではなく、異なる作用機序を有し、離脱症候群はない。 甲状腺生物調節剤を服用すると、甲状腺が機能するように離乳するのではなく、自然に適切な量のホルモンを作り出すのを助けるだけです。
ペプチドはアレルギー、突然変異、腫瘍学的疾患を引き起こしますか?
ペプチド生体調節剤は異物ではなく、身体によって拒絶されない。 生物調節研究所とペプチド会社によって開発された新世代のペプチドはよく精製されており、細胞膜の残渣であるリン脂質は含まれていません。 それらは外来抗原ではなく、免疫応答を生成しません。 ペプチドはタンパク質合成の自然なプロセス(細胞に特有のもの)のみを引き起こすため、アレルギー反応はなく、突然変異は起こりません。
ペプチドの過剰摂取は可能ですか?
過剰摂取はあり得ません-過剰なペプチドは単に腎臓または腸を通して排泄されます。 この研究では、マウスで実験が行われました—膵臓ペプチドの薬用量は10万倍を超えました。 結果はありませんでした。
長年にわたり、老化は細胞から始まると考えられていました。 しかし、根本的な原因はより深いです。 私たちの全身は組織で構成されており、それらは20%の細胞と80%の細胞外マトリックスにすぎません。
細胞外マトリックスの破壊が老化の主な原因です。
これはどのようなマトリックスですか? これは細胞のための一種の結合媒体です。 それは細胞間の薄い隙間(例えば、肝臓および筋肉内)を埋めることができ、空間の大部分(例えば、結合組織、骨および軟骨組織の細胞間)を埋めることがで
細胞外マトリックスには3つの主要なコンポーネントが含まれています:
-コラーゲン;
-接着性タンパク質(マトリックスの様々な成分を結合し、細胞を固定する);
-プロテオグリカン(これは重要な成分であり、プロテオグリカンはマトリックスの充填剤として機能し、その主な物質です)。
細胞外マトリックス機能:
組織や臓器の骨格を形成する;
それは細胞の発達と代謝に直接影響を与えます;
それは普遍的な「生物学的接着剤」です;
体内の水と塩の代謝の調節に参加します;
いくつかの構造(軟骨、骨、腱、歯)を形成する;
体の調節システムからの信号を細胞に送信します。 これは、神経系、心臓血管系、内分泌系および免疫系の助けを借りて、電気インパルスを伝達し、体内で情報交換を提供する生物学的に活性な物質である好中球伝達物質を制御する細胞外マトリックスである。
栄養素と酸素が血液からマトリックスを通って細胞に移動する”分子篩”の役割を果たします。 逆のプロセスも起こります:マトリックスを通る細胞は、毒素、二酸化炭素および崩壊生成物(代謝産物)を血液中に除去します;
血液から細胞受容体へのホルモンの動きを提供します;
神経終末からのメディエーターの動きを提供します。
細胞外マトリックスと老化
細胞外マトリックスの破壊プロセスは超高速ではありません。 最初の破壊的な変化は通常20歳で始まり、時にはそれよりも早く始まります。
行列はどのように変化しますか:
1. 健全なマトリックスは、均質で均一な構造-ゾルである。 すべての行列関数が有効です。
2. 有害な要因の影響下で、毒素はマトリックス中に蓄積し、pHはより酸性環境に向かってシフトする。 これは、(高分子糖への水分子の引力による)細胞外マトリックスの膨潤を引き起こし、それをゲル状態に変換する。 マトリックスは酸性化され、不均一になり、圧縮されます。 細胞内の代謝が遅くなり、酸素のアクセスと二酸化炭素の除去が困難になります。
3. 毒素は糖と化学結合を形成する。 重合は細胞外マトリックスの構造で起こる。 細胞は崩壊生成物の排泄に対処するのをやめ、十分な栄養を受けません。 慢性疾患の発症が始まります。
4. 毒素が細胞外マトリックスに蓄積すると、有害な成分が細胞の深さに浸透し、その細胞質の構造(タンパク質含有量)に影響を与えます。 たとえば、ミトコンドリアは毒素の影響を受けます。 その結果、細胞の自己調節(恒常性)が著しく破壊され、酸性化される。 そして、酸素飢餓の結果として、好気性の代わりに嫌気性解糖が細胞内で引き起こされます。 これはどういう意味ですか?
好気性解糖は、エネルギーの形成のために、酸素の関与によるグルコースの分解である。
嫌気性解糖は、酸素を含まないブドウ糖の分解です。 低酸素症-酸素飢餓を有する細胞においてのみ起こる。 その結果、乳酸-乳酸が形成される。
5. 細胞内の一定のエネルギー欠損は、細胞核が情報を受け取るという事実につながる:より多くのミトコンドリアを産生する必要がある。 これは非特異的な細胞分裂を引き起こす。 細胞は制御不能に増殖する。 そして悪性腫瘍が形成される。 過剰な乳酸が細胞外マトリックスに入り始めます。 そして、それは免疫細胞に対して実質的に不浸透性になるほど再構築されます。
多くの老年学者(体の老化の原因とそれに抵抗する方法の研究の専門家)は、腫瘍学的疾患が老化の兆候の1つであることに同意します。
細胞外マトリックスの破壊は証拠の1つです。
老化を止めることは可能ですか?
体の老化のメカニズムの知識は、組織や臓器の早期変化を防ぐのに役立ちます。 そして今、主な理由が細胞外マトリックスの構造の違反であることがすでに証明されているとき、誰もが望むならば、そして忍耐を持って、彼らの状態を改善し、回復と若返りに向かって動き始めることができます。
すべての種類の糖に注意してください。 それらは糖化/糖化につながります-加速された老化の主な原因。 ブドウ糖は文字通りコラーゲンを接着し、細胞外マトリックスにいわゆる垂直「架橋」を形成します。
このようなタンパク質の「架橋」が多いほど、組織の弾性は低くなります。 細胞外マトリックスは硬い物質に変わります。 同時に、皮膚だけでなく、目の関節、毛細血管、網膜も苦しんでいます。
甘い歯が早く老化するというのは本当ですか?
速い炭水化物について話す必要はありません:お菓子、ケーキ、ケーキ、その他の同様のデザートの助けを借りてお菓子の渇きを癒すと、糖化は急速に進みま ドライフルーツと新鮮な果物はすでに遅い炭水化物ですが、それらの過剰は「架橋」の形成につながります。
適度に健康的なお菓子をお楽しみください。
紫外線への過度の暴露を避けてください。 日焼けをしたいという願望は比較的新しい傾向です。 100年以上前、貴族はつばの広い帽子や傘の下で太陽の光から顔を隠しました。 そして今、例えば、正気の日本人女性は彼女の肌を有害な放射線にさらすことはありません。 どんな女性も太陽のように肌を老化させるものは何もないことを知っているからです。
いわゆる「老齢の三角形」、つまり通常ドレスに切り欠きがある部分のデコルテエリアを見るだけで十分です。 この領域の皮膚はまずしわになり、「鶏の尾」に変わります。 しかし、通常は水着/衣服で覆われている胸の部分は、若さをより長く保持します。
顔について話す必要はありません:太陽はコラーゲンとエラスチン繊維の不可逆的な変化を引き起こし、色素沈着を引き起こし、マトリックスタンパク質を破壊する酵素(つまり、実際にコラーゲンを破壊する)の産生を引き起こします。
タバコの煙はできるだけ避けてください。 そして、一般的にそれが喫煙されている部屋にいることについて。 2015年にドイツの研究大学で行われた研究では、タバコの煙がエストロゲン欠乏症と同じように体に影響を与えることが証明されました。それは皮膚の代謝を悪化させ、創傷治癒を遅くし、すべてのタイプの細胞外マトリックスタンパク質を破壊します。
低カロリーの食事は、糖化の速度を減らすのに役立ちます。 長寿命のコラーゲン繊維は、細胞外マトリックスで定期的に交換されます:10年ごと。 ただし、これはすでに糖化されているコラーゲンには適用されません。
通常、20歳で、人は糖化の結果としてコラーゲンの「架橋」に最初に現れます。 糖化コラーゲンの量は毎年3.7%増加します。 80歳までに、「ステッチ」の数は50%に増加します。
糖化は、お菓子の過度の消費の結果としてだけではありません。 糖化の最終生成物は体内に蓄積し、揚げ物、脂肪のための大きな愛のために蓄積します。
低血糖指数の食品を食べることは、早期老化を防ぎ、若さを延ばすのに役立ちます。
ビタミンDを摂取すると、肝線維症が予防されます。 線維症は、瘢痕の形成を伴う結合組織の成長である。 細胞外マトリックス中の線維芽細胞およびI型およびIII型コラーゲンがこのプロセスに関与する。
ビタミンDを摂取すると、I型コラーゲンの形成が抑制され、結合組織の成長が妨げられます。
肝線維症の危険性は何ですか? 体がその主な機能を果たすのをやめるという事実:
-アミノ酸(タンパク質代謝)。 血液凝固を確実にするタンパク質が形成されるのは肝臓で。
-免疫(感染性およびその他の有害な要因に対する保護)。
-脂肪、炭水化物とのタンパク質複合体の形成。
-複合体の形成-貴重な元素のキャリア。 例えば、体内に鉄を運ぶトランスフェリン。
-最終生成物へのタンパク質の切断-アンモニアおよび尿素(その後の腎臓を通る排泄のために)。 同時に、肝臓はアンモニアを中和する。 しかし、線維症では、臓器はもはやそのような機能を果たすことができず、その結果、アンモニアが血液中に蓄積し、昏睡までの中枢神経系の重篤な障害につながる可能性があります。
-脂質(脂肪)代謝。 肝臓で脂肪を分割する過程で、脂肪および他の酸が形成される。
-炭水化物代謝。 グリコーゲンが合成され分解され、フルクトースとガラクトースがブドウ糖に変換され、ブドウ糖自体が酸化されます。
-ビタミンの同化、貯蔵および形成。
-体の解毒。
-貴重な元素(鉄、銅など)の交換への参加。
-きれいな肝臓は、一般的に私たちの若さ、美しさ、健康です。
あなたの血圧を監視します。 高血圧は、ホルモンアンジオテンシンIIおよびアルドステロンのレベルの上昇を引き起こす。 そして、彼らは、順番に、組織や臓器の線維症を刺激します。 低血圧の人々は高血圧の患者より遅く老化する傾向があります。
以前、私は私の低血圧(80/50、せいぜい-90/60)を本当の災害と考えました:弱さの感覚はほぼ一日中悩まされ、免疫システムもしばしば機能不全になりました。
しかしhypotonicsは実際により容易である:有用な身体活動および健康練習は大いによりよく感じるのを助ける。 そして、加齢に関連した皮膚の変化は、確かに、高血圧に苦しんでいる人々よりも遅く現れます。
高血圧患者の血圧を下げるための推奨事項:
-穏やかなペースで深呼吸;
-指圧(人差し指と親指の間の手のひらの外側);
-首から空のボトルに空気を吐き出す:鼻から吸い込み、口から吐き出す;
-1分間熱いシャワーを浴びる;
-コントラストフットバス;
-足にリンゴ酢で圧縮する(15-20分間);
-架空の飲み物(カルカデとサンザシからのお茶、ビートジュース、クランベリージュース);
-スイカと柿。
揚げ物の拒否。 そして、それは肥満のリスクを高めることではありません。 米国のMount Sinai Medical Schoolのスタッフは、2008年にマウスの食事を変えて多くの研究を行いました。 そして、彼らは、食品中の糖化最終生成物の量が減少した場合にのみ、平均余命が増加することを発見しました。 さらに、速い炭水化物の消費を減らすだけでは十分ではありません。 平均余命の増加は、揚げ物、焼きたての食べ物、そして古くから保存されている脂肪や古い動物の脂肪を与えられていない人にのみ認められました。
事実は、揚げるプロセスの間に、糖化最終生成物の量が記録的なペースで増加するということです。 これらの有害な成分のほとんどは揚げベーコンに含まれています。 バターは2位になります。 たとえば、100gの揚げベーコンには、私たちの体がせいぜい1週間で中和できるのと同じくらいのカルボキシメチリシンが含まれています。
できるだけ少ない糖化最終生成物を消費するための最も健康的な食事は、生の野菜、蒸したお粥、ゆでた肉や魚、発酵乳製品です。
製品の処理温度が高いほど(オーブンおよび圧力鍋を含む)、完成した皿にはより多くの糖化最終生成物が含まれています。
過度の身体活動は心臓の線維症を刺激する。 例えば、2012年には、カンザスシティ(米国)の病院の研究所がマラソンランナーの間で研究を行った。 男性の半数はMRIで心臓線維症を認め,症状なしに進行した。 47人のマラソンランナーが大動脈のこわばりを示しました。 これらはすべて、細胞外マトリックス内のコラーゲン成長の指標であり、その後の圧縮および弾力性の喪失を伴う。
座りがちな生活は時期尚早の老化を引き起こします。 しかし、あまりにも、過度にアクティブ。 そして、いつものように、真実は真ん中のどこかにあります。 いずれの場合も、対策が重要です。
リンパ系の機能を改善することで、細胞外マトリックスを浄化することができます。 細胞外マトリックスの習慣機能は、医学、生物物理学および生態学の分野におけるロシアの科学者によって1966年に発見された-V.P.Kaznacheev、MD。 彼は、細胞外マトリックスが栄養素の輸送を投与し、必要なものだけを通過させることを発見しました。 彼は残りを自分の中に保ち、それを水と一緒にリンパ毛細血管に送ります。
しかし、微小循環が中断されると、「毒素」が細胞外マトリックスをスラッガーします。 リンパの不十分な産生およびその流出のために、水が組織内に停滞する。 外部的には、この状態を浮腫として評価します。
そのため、定期的に「リンパを分散させる」ことが非常に重要であり、リンパドレナージの練習とテクニックを実行します。 これはすべて、細胞外マトリックスを浄化し、それによって体を若返らせるのに役立ちます。
アロマセラピー… 2003年には、特定の精油がエラスターゼの活性を抑制することができることを証明したin vitro研究(人工条件下)が行われた。
エラスターゼは、コラーゲンとエラスチン繊維を破壊する酵素です。
年齢とともに、この酵素の活性が増加する。 そして、繊維のさらなる破壊を防ぐために、エッセンシャルオイルを使ったアロマセラピーが役立ちます:
-柑橘系の果物(特に組み合わせていますが、レモンとグレープフルーツオイルを別々に使用することもできます);
-ジュニパー;
-黒コショウ
抗酸化療法。 簡単に言えば、酸化防止剤は酸化を防ぐ分子です。 細胞外マトリックスを含む。 抗酸化物質は栄養素の循環を促進し、代謝を改善します。 抗酸化物質はまた、フリーラジカルと戦います-電子を失い、隣接する分子を攻撃し始める分子。
体の酸化は、生物学的腐食と呼ばれることもあります。 抗酸化物質はそれを止めるために使用されます。
抗酸化療法は次の方法で可能です:
-エッセンシャルオイル(ノコギリソウ、フランキンセンス、イランイラン、レモン、ミルラ、マジョラム、バジル、ローズマリー、タイム)とアロマセラピー;
-植物油の摂取。 各植物油には、抗酸化特性を有するビタミンE(トコフェロール)が含まれています。 酸化防止剤は熱処理中に部分的に破壊されるため、未精製の冷間圧搾油が最も価値があります。
最も豊富な供給源は、ホホバ油、ヘーゼルナッツ、ヒマワリ、ゴマ、カボチャの種、海クロウメモドキ、アボカドです。
若い細胞外マトリックスでは、古い細胞が若返っていることが証明されています。 そしてその逆:古い細胞外マトリックスでは、若い細胞でさえ老化します。
残念ながら、マトリックス自体を若返らせる方法はまだありません。 しかし、その老化を遅らせ、その弾力性の喪失を防ぐオプションがあります。 そして、これはすべて、彼の健康を監視し、活発な長寿を数えることに決めた人にとってはかなり可能です。
共通の真実について:
-毎日有用な身体活動(特に歩行)に注意を払うことがいかに重要であるか;
-より頻繁に屋外にいること(酸素濃縮も抗酸化療法です);
-健康的な毎日のルーチンを遵守してください(夜の睡眠だけがメラトニンの若返り効果を提供します)。
今回は、市販されているPDRN/PN製品の種類と、美容内科医による美容・アンチエイジング治療の実際の臨床内容について、クリニック関連の資料に基づいてお話したいと思います。
PDRN は、野生サケ (oncorhynchus keta/oncorhynchus mykiss) の精巣/精子から抽出されたプリンとピリミジン ヌクレオチドが、ホスホジエステル結合による不活化プロセスを通じて結合されている 50 ~ 2000 塩基のデオキシリボヌクレオチド ポリマーです。
これは、過剰な炎症反応または組織損傷の場合に迅速な組織再生を促進する再生可能な物質 (DNA フラグメント) です。
PDRN のこの作用メカニズムに基づいて、より高い分子量を持つより長い DNA 断片を厚くして三次元の多孔質足場 (PN) を形成することができます。
PDRN/PNを含む製品
現在、日本市場でPDRN/PNを主成分とする製品は、注射剤(医薬品および医療機器)と非注射剤(化粧品)の2つに分類できます。
または、PDRN/PN を単独の薬剤として使用する製品、または PDRN/PN と他の肌改善成分を混合した製品に分けることができます。
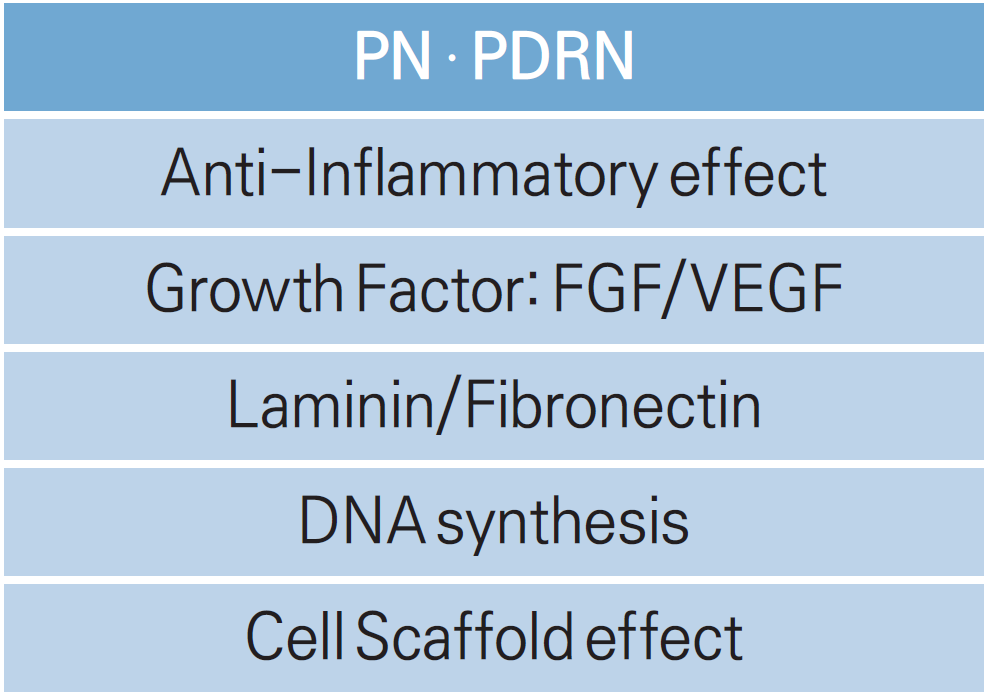
これらの製品はすべて次の原因を引き起こします。
①抗炎症作用
②FGF/VEGF刺激
③ラミニン・フィブロネクチンの生産
④DNA合成
A2A受容体に対するPDRNの一次作用とサルベージ経路に沿った双方向作用の二重作用により、組織再生と創傷治癒の中核効果を活用することで、美容とアンチエイジングの観点からさまざまな臨床適応を改善します。
PDRN/PN を含む注射製品を製造する最良の企業の 1 つが、日本企業のラセルタ東京株式会社です。 2001 年から市場に投入され、日本市場では比類のない高品質の原材料と高品質の製品を生産しています。
ラケルタ東京の製品ラインは、さまざまな肌タイプや患者の臨床症状に適用できます。
前述の PDRN/PN 製品ラインとは異なり、化粧品として承認された製品は皮膚に注射できません。 これらは、MTS やダーマローラーなどのマイクロニードル、フラクショナル レーザー、またはイオン導入、電気泳動、超音波導入などのさまざまな経皮送達システム (TDS) を使用して真皮に浸透する必要があります。
ラミニンとフィブロネクチンの生成と作用
線維芽細胞は、コラーゲンを再生するための PDRN/PN の主な作用機序による FGF 刺激によって生成されます。
VEGF・アンジオポエチンによる血管新生による皮膚環境の再生が基本原理ですが、健康な皮膚を促進し、老化を抑制するために、ラミニンとフィブロネクチンの生成に着目しています。
表皮と真皮の間の境界および接続を形成する基底膜(BM)の最も重要な成分であるラミニンの発現がPDRNによって増加することは、多くの研究ですでに実証されています。
ラミニンは、高密度層CMに位置する十字型のタンパク質であり、表皮と真皮の相互作用(パラクリンネットワーク)に重要な役割を果たし、多くの細胞の作用に関与する橋状物質です。
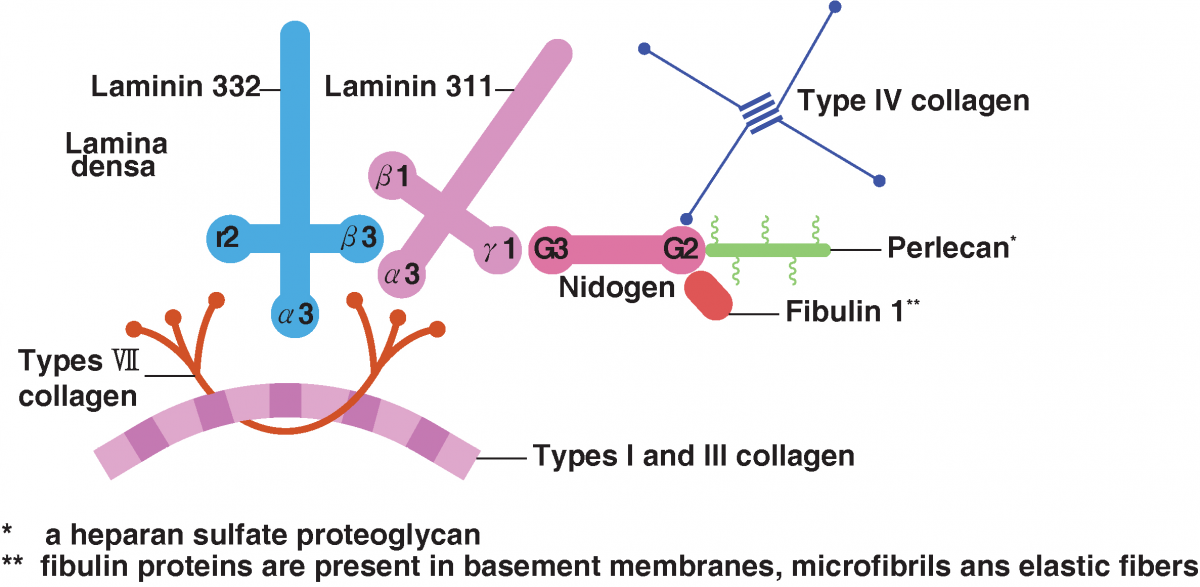
表皮ケラチノサイト、ラミニン、IV型およびVII型コラーゲン、および上部真皮乳頭のI型およびIII型コラーゲンは、表皮および真皮の成長および再生への関与と密接に関連している。
したがって、PDRN/PNは、抗炎症作用、血管新生、コラーゲン再生による真皮再生、BMの重要な成分であるラミニンとフィブロネクチンの生成を誘導し、表皮-BM-真皮の3段階の結合を強化します。
創傷治癒におけるラミニンとフィブロネクチン
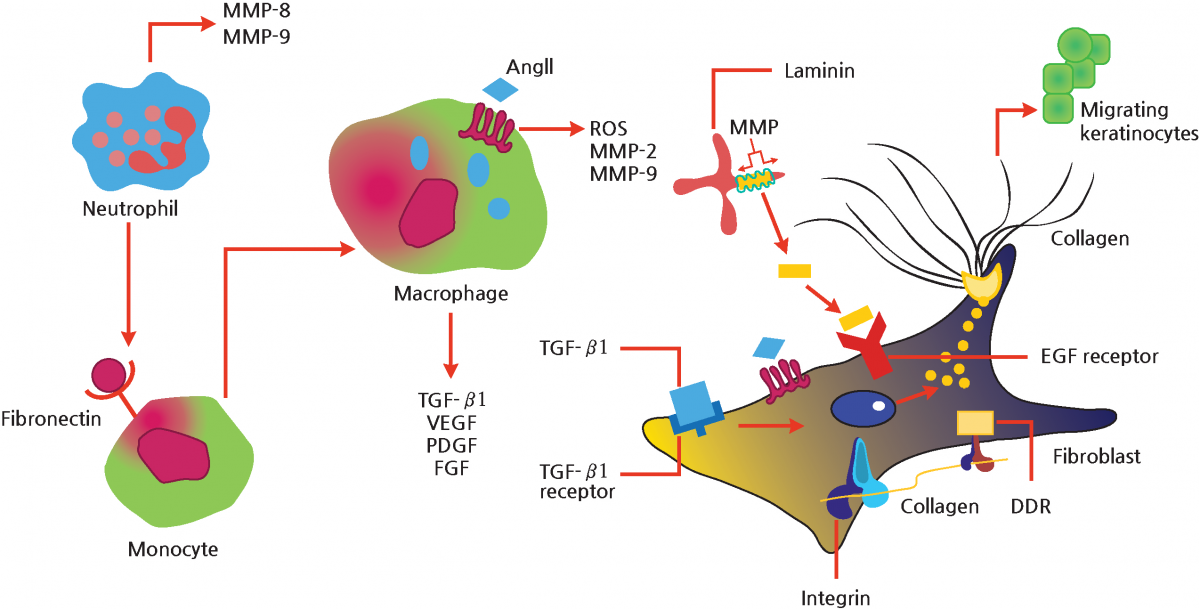
皮膚が損傷すると、単球がその部位に移動し、好中球が分泌するフィブロネクチンと反応してマクロファージに分化し、創傷治癒に重要な役割を果たすTGF-β1、VEGF、PDGF、FGFを分泌します。
一方、マトリックスメタロプロテイナーゼ (MMP) はラミニンを断片化し、線維芽細胞の ECF 受容体に結合し、ケラチノサイトの移動と増殖に関与します。
したがって、ケラチノサイト、線維芽細胞、ラミニン、フィブロネクチンは互いに密接に関連しており、その過程でさまざまな成長因子が細胞外マトリックス(ECM)の修復と再生を誘導します。
さらに、ラミニンとフィブロネクチンは創傷治癒に重要な役割を果たします。
図 4 は、創傷部位の再生における ECM、成長因子、MMP の相互作用を概略的に示しており、創傷治癒におけるラミニンとフィブロネクチンの重要な作用を示しています。
皮膚の老化は本質的に、紫外線による真皮への慢性的なダメージです。
エネルギーベースのデバイス(EBD)、レーザー/光、高周波、高焦点超音波を使用して外来クリニックで行うさまざまなアンチエイジング治療も、熱を使用して真皮への一時的な損傷をターゲットとしています。
ダメージを受けた部分が再生される際にはコラーゲンが合成され、若返りが起こります。
これに関連して、皮膚ブースター、特に PDRN/PN は、創傷治癒プロセスにおいて重要な役割を果たす可能性があります。
結論として、PDRN/PN はコラーゲン、ラミニン、フィブロネクチンなどのさまざまな皮内成分の再生を促進し、ECM を再び強くて健康にし、敏感肌の改善、アンチエイジング効果、美容の改善につながる可能性があります。 。
次回は、より臨床的有用性の高い研究を中心に、PDRN/PNと現実の臨床状況との関係について説明したいと思います。
調節ペプチド (RP) は、アミノ酸残基の連続鎖からなる生物学的に活性な物質であり、人体や動物の体内で複数の多機能的な役割を果たします。 組織や器官に応じて、同じ分子が神経伝達物質、神経調節物質、神経ホルモン、局所ホルモンとなる場合があります。 他の細胞間シグナル伝達システムと比較して、ペプチドシステムは最も多項式であり(1,000 を超える天然 RP がすでに発見されており、40 を超えるファミリーを形成している)、多機能であることが判明し、ペプチドの機能はしばしば重複します。
調節ペプチドのシステムは、いわゆる機能的連続体(機能的連続システム)を形成します。 生物学的活性の多種多様な複合体を提供することに加えて、ペプチド連続体は別の機能、つまり複雑な制御鎖の形成を実行します。 各 RP は、血液、脳脊髄液、および体の細胞間環境への特定の RP の放出を誘導する能力を持っています。 この相互誘導システムの特殊なケースは、視床下部のリベリンとスタチンが下垂体ホルモンの出力に与える影響です。 別のペプチドによって出力が誘導される各 RP は、次の RP の出力を誘導することができるため、一連の調節プロセスが発生します。 このような連鎖がどれくらい長くなるかを判断するのは、現時点では難しい。 しかし、半減期が数分で測定される多くのRPは、体内に投与された後、数時間、さらには数日間の効果を引き起こす可能性があることが知られています。 おそらく、その基礎はこのような一連の規制プロセスにあると思われます。 短期段階からなる長期制御プロセスの存在の生物学的意味は明らかです。 長寿命レギュレータに基づくシステムとは異なり、このようなシステムは、新しい信号が到着したときなど、変化する状況に対してより柔軟です。
ポーランド共和国の秩序ある規制使命の基本法は、「何?」という原則です。 どこ? いつ?” (何ですか? – どのペプチドですか? どこで? – その発現は体のどの遺伝子座で行われますか? いつ? – その合成はいつ行われますか?)。 この原理は、適切な場所および適切なタイミングで、対応するペプチドの合成および/または放出を最適かつ機動的に組み合わせるペプチドの能力によって達成されます。
PIL の構造 ペプチドはアミノ酸の組み合わせとして構築されます。 調節ペプチドには 3 つのカテゴリーがあります。 ペプチドがあるカテゴリーに属するか別のカテゴリーに属するかを決定する兆候は次のとおりです: アミノ酸組成、半減期、寿命、受容体に対する親和性の程度、特殊な前駆体タンパク質の有無、トランスポータータンパク質の有無、このペプチドの生産器官の存在。
RP のカテゴリー I (古典的) には、半減期が短く、受容体に対する親和性が高い、作用のタイプが異なるペプチドが含まれます。 これらは中小型のペプチドで、2 ~ 60 アミノ酸残基からなり、特殊な前駆体タンパク質と特殊なキャリアタンパク質を持っています。 このカテゴリーのほとんどのペプチドには生産器官があります。
カテゴリー II の RP は比較的最近発見されました。これらはグリプロリン、小さなペプチド、アミノ酸数 2 ~ 7、プロリン含量が高いものです。 これにはいくつかのエキソルフィンも含まれます。 このカテゴリーの代表的なものは、半減期が非常に長く、受容体に対する親和性が低く、特殊化されていない前駆体タンパク質 (コラーゲン、エラスチン) を持っています。 ペプチドは血液系や胃や腸の粘膜に遠隔的な影響を与えます。
カテゴリー III の RP は、受容体に対する親和性が低く、特殊な前駆体タンパク質を持たず、アミノ酸の数は 2 ~ 60 の範囲にあります。このグループの代表的なものは、局所的に重要な組織特異的ペプチドとして分類されます。 半減期が短いため、遠隔作用は不可能です。
調節ペプチドの生合成(プロセシング)。 ペプチド合成の生化学的な「台所」は、すべての体のシステムで同じであることが判明しました。 十分に研究されているすべての RP の生合成の一般原理は、比較的大きな前駆体ペプチドの形成であり、翻訳完了後、対応する RP がプロテイナーゼによって切断されます。 一般に、前駆体ペプチドにはいくつかの主配列と、粗面小胞体での翻訳完了後(最初の数分間)細胞内で前駆体の移動を促進し、最後に切断されるいわゆるシグナル配列が含まれます。道のこの部分の。 多くの前駆体ペプチドはグリコシドとの中間体を形成しますが、これはプロセシングのいくつかの段階で安定化効果もあり、プロテイナーゼによる攻撃部位の選択に影響を与えます。
翻訳後(ゴルジ複合体内、軸索に沿った移動中および小胞形成中)数十分または 1 時間以内に NP の切断を確実に行うプロテイナーゼは、特異性がそれほど高くありません。 正確な切断の大部分は、アミノ酸配列内のペプチド (対になった残基の前駆体) の存在によって決まります。 それらは主に、カテプシン B やトリプシンと同様の作用を持つプロテイナーゼによって攻撃されます。 多くの場合、この処理フェーズ中に除去されたフラグメントはすでにアクティブな RP を表しています。 場合によっては、これらのフラグメントは再びさらなるタンパク質分解を受けて、新しい RP が形成されます。 この段階では、トリプシン様プロテイナーゼだけでなく、特異性もそれほど高くない他の多くのプロテイナーゼの関与も報告されている。
調節ペプチドの受容。 RP は、情報信号が生理学的作用に変換される特殊な膜構造である受容体と相互作用します。 現時点では、調節ペプチドに特化した単離された受容体の存在に疑いの余地はありません。 さらに、RP に特異的に結合する膜分子構造は、場合によっては古典的な神経伝達物質受容体の一部です。 この例としては、エンドゼピンの受容体である GABAA 受容体が挙げられます。
RP と細胞膜上の受容体が接触した後に細胞内で起こる生理学的プロセスは、セカンド メッセンジャー システムの活性化を引き起こします。 この場合、ペプチドによっては 1 種類のみのセカンド メッセンジャーの形成を誘導できるものもあれば、受容体の種類に応じて数種類のセカンド メッセンジャーの含有量を変化させるものもあります。
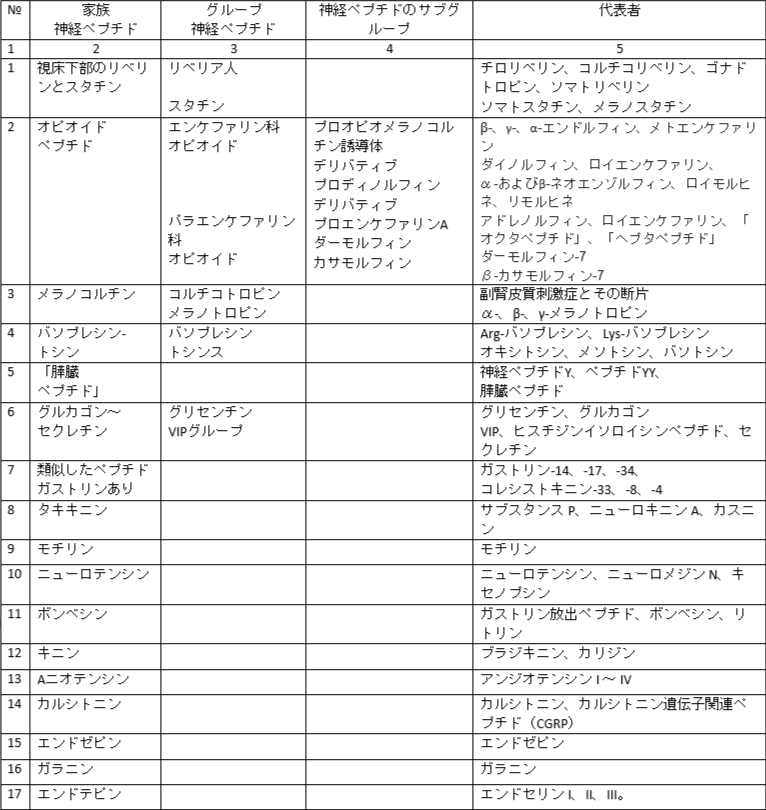
神経ペプチド (NP) は、主に神経細胞における情報の化学伝達において重要な位置を占める普遍的なペプチド制御因子です。 NP カテゴリには通常、2 ~ 50 ~ 60 アミノ酸残基の小および中サイズのペプチドが含まれます。 多くのホルモン、いくつかの細胞成長因子、およびその他の多くの因子を含むより大きなペプチドは、通常 100 を超えるアミノ酸残基を含み、通常は調節タンパク質として分類されます。 ほとんどの NP は直鎖状ペプチドです。 それらの C 末端アミノ酸はアミド化されていることが多く、N 末端グルタミン酸残基はピログルタミン酸で表されることがよくあります。 a/c 残基の他の修飾はまれです。 NP は、大きな前駆体ペプチドの限定的なタンパク質分解の結果として形成され、非ペプチドメディエーターで知られている機構と同様の機構を使用して分泌されます。
NPの局在化。 NP は脳および末梢神経系に広く存在します。 ペプチドの含有量は、10-12-10-9 M の間で変化します。さらに、多くの臓器や組織では、多くの NP と同一または類似のペプチドが合成され、非神経細胞によって分泌されます。 このため、NP を体の一般的な調節ペプチドシステムの一部として考慮する必要があります。 同時に、いくつかの用語上の困難も生じます。 たとえば、内分泌腺、心筋細胞、消化管細胞および免疫系で生成されるペプチドは、末梢神経系および中枢神経系の活動に影響を与える可能性があります。 それらはニューロン起源ではありませんが、特に中枢神経系で慎重に行われたほとんどすべての実験でも、末梢で見られるものと同一のペプチドを合成するニューロンが明らかになっているため、明らかにNPとして分類されるべきです(表1)。
表1
細胞間情報伝達を行う他の物質の中での神経ペプチドの位置

ペプチド伝達の特徴。 ペプチド作動性ニューロンは、中枢神経系およびメタ交感神経系に広く存在します。 ペプチド作動性ニューロンは基本的に他のニューロンと同様であり、ペプチドメディエーターの合成、沈着、分泌のための生化学的および生理学的メカニズムを備えています。 ペプチド作動性シナプスも、他の化学的性質のシナプスと基本的には変わりません。 しかし、多くの場合、ペプチドはシナプス内ではなくペプチド作動性ニューロンの末端から放出され、グリアまたは血液中に直接放出され、シナプス外モジュレーターまたは神経ホルモンの機能を果たします。 さらに、ペプチドはペプチド作動性ニューロンの末端からだけでなく、他の非ペプチド作動性ニューロンの末端からも放出される可能性があります。 この場合、ペプチドはシナプスモジュレーター(共伝達物質、コモジュレーター)として機能します。
ただし、ペプチド伝達では次の特徴が区別されます。
1. NP は、10 ミリ秒から 1 ~ 2 時間まで、体の体液中に非常に長時間存在します。これが、細胞に対する長期的な調節効果の可能性を決定します。
2. すべての NP は共通の生合成前駆体を持っています。
3. NP の生合成は、プロテアーゼによる前駆体ペプチドからの切断によって行われます。
4. NP 分解生成物は生物学的に活性な化合物であり、それらは独自の生物学的活性スペクトルを持ち、多くの場合、その前任者の活性スペクトルとは反対です。 彼らの活動の変化が観察されます。
5. ペプチド作動性伝達の特徴は、神経ペプチドの多様性です。 その数は非常に多い (> 50) ため、無限の組み合わせと相互影響が可能になります。
6. NP がシナプス間隙に分泌され、シナプス後受容体と相互作用した後、NP はシナプス前膜やグリア細胞によって再吸収されません。
神経ペプチドの処理。 神経ペプチドのプロセシングは、比較的大きな不活性な前駆体ペプチドの形成からなり、翻訳の完了後、対応する NP がプロテイナーゼによって切断されます。 このプロセスは粗いERで起こり、細胞ゲノムによって厳密に制御されます。
前駆体ペプチドには、1 つ以上の塩基性 (またはトリガー) アミノ酸配列が含まれています。 それらは構造が互いに大きく異なり、異なるクラスの神経ペプチドに属する場合があります。 さらに、ペプチド前駆体分子には、プロテイナーゼによる切断部位として機能するか、ペプチド作動性ニューロンの軸索末端への前駆体の移動を促進するいくつかのシグナル配列が必ず含まれます。 シグナル配列は次のとおりです: アルギニン-アルギニン、リジン-リジン、リジン-アルギニン、アルギニン-リジン。 前駆体ペプチドには、最大 200 ~ 300 個のアミノ酸配列が含まれる場合があります。 後者に加えて、その分子には一時的に結合するグリコシド陽イオンが含まれており、末端への輸送中に分子に安定化効果を及ぼし、プロテイナーゼによる攻撃部位を決定します。
神経ペプチド合成の前駆体はいくつか知られていますが、よく研究されているのは 3 つだけです。 これらはエンドルフィンとエンケファリンの主な供給源です。 これらは、プロオピオメラノコルチン、プロエンケファリン A、プロエンケファリン B です。
プロオピオメラノコルチンは 265 のアミノ酸配列を持ち、ベータ エンドルフィン、ACTH、アルファ、ベータ、ガンマ メラノサイト刺激ホルモンを含んでいます。 その最小トリガー配列はメテンケファリンです。 その合成は、下垂体の前葉と中葉、視床下部、その他の脳領域の細胞、さらに胃腸管、胎盤、肺に局在しています。 この前駆体から ACTH1-39 が形成されます。 ACTH 1-24; ACTH 18-39、アルファ、ベータ、ガンマメラノサイト刺激ホルモン、ベータ、ガンマ、アルファエンドルフィン、メテンケファリン、およびその他のあまり知られていない神経ペプチド。
プロエンケファリン A は 263 個のアミノ酸配列から構成されます。 トリガー配列はロイエンケファリンです。 この前駆体は、さまざまなエンケファリンの主な供給源となります。
プロエンケファリン B は 256 個のアミノ酸配列で構成され、エンドルフィンの主な供給源となります。 最小トリガー配列はロイエンケファリンです。
さらに、アルブミン、免疫グロブリン G、つまりアルブミンの分解中に神経活性物質が形成される可能性があることが示されています。 これらの生体有機分子は、神経ペプチドやその他の調節ペプチドの前駆体と考えることができます。
すべての神経ペプチドは、1 つのニューロンまたは 1 つの末端で同時に形成されるのではなく、特定のニューロンまたは神経末端のプロテイナーゼのセットに選択的に依存して形成されることを強調しなければなりません。
神経ペプチド不活化の経路。 勉強が足りません。 と知られている;
1. 多くの場合、ペプチドを切断する酵素であるアミノペプチダーゼやカルボキシペプチダーゼは、シナプス後膜上に存在することもあれば、シナプス外(たとえば、平滑筋細胞や血液細胞上)に存在するペプチド受容体と関連しています。
2. ペプチドと受容体との相互作用中に形成された複合体は、細胞サイトゾルへの内部移行を受け、輸送されます。
1) リソソームに入り、そこでペプチドはアミノペプチダーゼおよびkgfbオキシペプチダーゼによって切断されます。 2) またはサイトゾル受容体に影響を与える
3. 分解酵素は、ある段階では多くのペプチドに共通である場合がありますが、ある段階では非常に特異的である場合があります。 さらに、古典的なメディエーターを代謝する酵素が分解に関与している場合もあります。 たとえば、サブスタンス P の場合、そのような酵素はコリンエステラーゼである可能性があります。
4. 体内の多くのペプチドでは、合成と分解の酵素系、ペプチド自体とその受容体の最大密度の分布が一致しないことが非常に多く、これはこれらすべてのプロセスが異なる領域で観察されることを示しています。
5. ペプチドの分解は非常に早くアミノ酸に起こります。 外因性エンケファリンはイヌおよびヒトの血漿中で 2 分以内、メラノサイト刺激ホルモン – 1.6 分、ACTH – 2 ~ 5 分、サブスタンス P – 3 ~ 4 分以内に分解されます。
6. 多くの著者は、同じペプチドの切断速度の種特異的な性質に注目しています
7. インビボとインビトロでのペプチド分解速度は一致しないことが判明した。 一部のペプチド (α-メラノサイト刺激ホルモン) は、in vitro では切断されません
8. 多くの研究者は、一部の外因性ペプチドと内因性ペプチド (同じもの) が異なる酵素系によって分解される可能性があることに注目しています。 神経ペプチド受容体。 神経ペプチドの生理学的効果は、膜およびサイトゾル受容体を通じて実現されます。 それらは非常に具体的です。 各神経ペプチドには独自の受容体があり、場合によっては 2 つあります。 神経ペプチド受容体は次のとおりです。
– 独立したタンパク質-脂質複合体として、脂質がタンパク質と同様に重要な役割を果たします。
– および複合受容体。時には古典的な神経伝達物質の受容体の一部を表します。
– 構造的に可動な構造。
– クラスタリングが可能。 いわゆる受容体ピットの膜表面では、それらはグリコカレックスと複合体を形成して 2 ~ 12 個の分子のグループにグループ化されており、サイトゾルに取り込まれてサイトゾル受容体と相互作用することができます。
– 溶液中のほとんどの神経ペプチドは構造的に可動な構造であり、それらの受容体との相互作用は、「動的ファーマコフォア」の概念、またはリガンドと受容体の間で相互に誘導される対応関係に基づいて最もよく説明されます。
– あらゆる既知の機構を結合機構として使用できます。 多くの場合、1 つの受容体は 2 つの機構に同時に関連付けられます。
神経ペプチド作動性システムと古典的な神経伝達物質の関係。 現在、次のことが完全に確立されています。
– 神経ペプチドとアミンは合成され、1 つの神経細胞内に保存されます。
– 神経ペプチドと古典的メディエーターの沈着は、同じ小胞内または異なる小胞内で発生します。
これらのデータに関連して、哺乳類の体内にびまん性神経内分泌系が存在し、その細胞がモノアミンと神経ペプチドを同時に産生するという概念が形成されました。 英米の文献では、このシステムは「APUD」(アミノ前駆体の取り込みと脱炭酸)と呼ばれています。 このシステムの特徴は次のとおりです。
1. まず、単一の前任者からの共通の発生学的起源。 「APUD」系の細胞は、中枢神経系および体性器官全体に分布しています。 それらはモノアミンと 40 を超える生理活性ペプチドを生成し、そのうち 15 は脳と胃腸管に共通の局在を持っています。
2. 神経ペプチドは、古典的な神経伝達物質と比較すると複雑な構造にもかかわらず、系統発生学的にはより古い制御因子です。 そして実際、新しい神経活性オリゴペプチド配列の形成の進化的経路は、非ペプチドメディエーターの形成よりもはるかに短いことが判明しています。 たとえば、チロシンからノルエピネフリンを系統的に形成するには、3 つの遺伝子の変化に基づく 3 つの新しい酵素 (DOPA デカルボキシラーゼ、チロシン ヒドロキシラーゼ、DA ベータ ヒドロキシラーゼ) の出現が必要です。 ACTH4-7 タイプのペプチド配列の形成には、1 つの遺伝子の限られた領域における少数のミス変異のみが必要です。
3. 神経ペプチドとモノアミンの共通性は、モノアミン受容体とペプチド調節因子の活性中心の構造にも現れています。 これは芳香族部分と (+) 電荷で構成されており、これがペプチドが一部のモノアミン受容体と相互作用する理由であると考えられます。
神経ペプチドの機能的重要性。 NP の多くは、シナプス内で信号を伝達する神経伝達物質として機能します。 この場合、NP は通常、非ペプチドメディエーターと「協力」します。 同じ神経終末において、非ペプチド神経伝達物質と 1 つ、2 つ、場合によっては 3 つの NP の特定の組み合わせが注目されます。 インパルスの周波数と持続時間に応じて、それらは一緒にまたは個別に区別されます。 このような NP は、コネイロトランスミッターまたはコネイロトランスミッターと呼ばれることもあります。 NP の生化学的特性が古典的なメディエーターとの機能的な違いを決定することに注意する必要があります。 最も明白なものは次のとおりです。
1. 体液中の NP、特にアミノ酸残基の数が 14 ~ 20 を超える中型および大型の NP の存在期間が長い。 これにより、シナプス内変調の持続時間と、遠隔シナプス系に対する遠隔作用の可能性が決まります。
2. NP の不完全なタンパク質分解の生成物には、特定の、しばしば高い特異的活性が存在します。 多くのペプチドのタンパク質分解は、単純な不活化としてではなく、それらの活性の変化として考えられています。
従来の神経伝達物質の数をはるかに超える、多数の異
なるNP。 これは、1 つのニューロン、1 つの端末内でのさまざまな NP と神経伝達物質の相互接続について、量的だけでなく質的にも新しい可能性を生み出します。
NP は、シナプスでの信号伝達に関与するだけでなく、狭い領域、器官内、さらには生物全体内で、より長距離にわたって情報を伝達することができます。 この場合、それらの機能はホルモン(組織ホルモンを含む)の機能と区別できません。 NP の遠隔作用の対象は、ニューロンのシナプス前領域およびシナプス後領域、および他の細胞です。 同時に、NP はインパルス伝達を促進または抑制し、ニューロンの状態に他の影響を与える可能性があります。 神経調節物質として機能します。 脳の異なる部分やサブセクション、異なるニューロンでは、同じ NP が神経伝達物質 (錐体伝達物質) または遠隔神経調節機能のいずれかを実行し、場合によってはそれらを組み合わせることもあります。
NP の最新の分類は、機能的、構造的、トポロジカル (合成場所に基づく) という 3 つの原則の組み合わせに基づいています (表 1 を参照)。
コカルシゲニン – CGRS (カルシトニン遺伝子関連ペプチド)。 コカルシゲニンの生物学的活性は非常に明確に現れます。人間の皮膚の下にこの NP が約 10 ~ 14 モルだけ導入されると、かなり長期間にわたる細動脈の拡張、血流の増加、および (特にサブスタンス P との併用による) 血液からの放散が引き起こされます。船。 コカルシゲニンは、VIP および Y ペプチドとともに、脳、冠状血管などの血管緊張の調節に関与します。 最近まで、それらは純粋に末梢的な起源と作用の要因と考えられていました。 それらの主な供給源は心房心筋細胞です。
アトリペプチドは利尿、特にナトリウム尿を大幅に増加させます。 しかし現在、アトリペプチドは脳内でも合成されることが証明されています。 中枢神経系におけるそれらの機能は、これまでのところ十分に研究されていません。
エンドゼピン。 これらは、GABA 受容体の負の制御因子です。 GABA 自体が、不安、恐怖、落ち着きのなさの感情を軽減する鎮静化などのさまざまなプロセスに関与する抑制性メディエーターとして機能する場合、エンドゼピンは逆に、落ち着きのなさ、不安、恐怖の出現を引き起こし、げっ歯類の実験では、対立行動。 明らかに、脳内で非常に広く表される GABA 作動性伝達の抑制は、エンドゼピンの生物学的活性の他の発現を示唆していますが、このグループの NP の研究は比較的最近に始まりました。 エンドゼピンは 100 個のアミノ酸残基からなり、その活性フラグメントは 18 員および 6 員の小さなペプチドであることが知られています。 それらの受容体は、GABA 受容体 (GABA 受容体) の一部、または GABA 受容体と密接に関連する独立した受容体です。
ソマトスタチン (SST)。 ソマトスタチンは 1973 年に牛の視床下部から初めて単離されました。 14個のアミノ酸残基から構成されます。 視床下部の放出因子の 1 つは抑制型です。 NA とともに交感神経系の単線維において免疫細胞化学的に初めて同定されました。 SSTはNAの放出を阻害します。 その後、心臓(迷走神経)の副交感神経線維のコリン作動性ニューロンでACh放出の強度が弱まることが確認されました。 古典的神経伝達物質の放出に対する SST のこの効果は、そのシナプス前調節効果と関連しています。
表1
神経ペプチドの分類 (Ashmaria I.P.、1999 による)
脊髄の交感神経経路では、P作動性線維、大脳皮質ではGABA作動性線維があり、SSTはサブスタンスPとGABAの放出を促進します。
人体では、SST は線状と環状の 2 つの生物学的形態で存在します。 前世代 – SST-28 => SST-14。 異なる組織では、CCT-28 と CCT-14 が異なる比率で見つかります。 CCT-28 および CCT-14 の前駆体はプロソマトスタチン -140 (140 アミノ酸残基からなる) です。 プロソマトスタチンのプロセシング中に、4 つの切断部位が可能であり、異なる分子量を持つ 7 つの体細胞様ペプチドが形成されますが、生物活性は CCT-28 と CCT-14 についてのみ検出されました。
ローカリゼーション。 ソマトスタチンの 75% は消化管に局在し、25% は脳に局在します。 SST の最大の活性は視床下部、胃、腸、膵臓であり、中枢神経系とメタ交感神経系の SST を含むニューロンで確認されます。 それらの密度が低いのは、大脳辺縁系および皮質、大脳基底核、下垂体、海馬、扁桃体、および脳幹の投射ニューロンです。
SST を含むニューロンは、嗅覚 (嗅球)、視覚 (網膜)、聴覚 (内膝状体) などの特殊な感覚系にも存在します。
ソマトスタチンは、胃粘膜 (前庭部)、膵臓、甲状腺の内分泌 D 細胞にも存在します。
SST-14 の半減期は 2 ~ 4 分で、SST-14 に比べて長くなります。他のペプチド。
受容体と結合機構。 SST は、ソマトスタチン受容体 (SST) を介して細胞に効果を発揮します。 5 つのタイプ (SSTi、2、3、4、5) があります。すべてのタイプの受容体が G タンパク質に関連付けられています。 この受容体の合成を制御する遺伝子がラットで特定されています。 受容体の分子構造は解読されています。 受容体は 7 つの膜貫通ドメインからなるオリゴペプチドです。 CNS では、受容体密度は次のように降順に分布しています。 皮質、視床、視床下部、線条体、延髄、脊髄(後角、中央灰白質)。
SST1 受容体は、SST1 タンパク質を介して AC と関連しています。 SST は細胞内の cAMP レベルを低下させます。 これは最も一般的なタイプの受容体ですが、その最大密度は視床下部にあります。 脳の多くの領域では、このタイプの受容体の興奮はニューロンのインパルス活動の抑制を伴います。 どちらの形態のソマトスタチンもこのタイプの受容体に結合しますが、CCT-14 の方がわずかに高い親和性を持っています。 合成起源のSST1受容体アンタゴニストが知られている。
SST2 – Ca^* および IC チャネルの活性を制御し、それらの活性化を阻害します。 この受容体の密度が最も高いのは、青斑核、下垂体のニューロン、および胃粘膜の細胞上にあります。 このタイプの受容体を通じて、CCT-14 の普遍的な阻害特性が現れます。 CCT-14 は、青斑核ニューロンのインパルス活動、成長ホルモンの合成を阻害し、逆説的な睡眠相の開始と塩酸の生成を阻害します。 合成アンタゴニストが入手可能です。
SST3 – サブタイプ A と B に分類されます。サブタイプ A は、Gi タンパク質を介して AC と関連付けられます。 サブタイプ B は、Gs タンパク質を介して FLS と関連しています。 脳の多くの構造や胃の筋肉層に存在しており、そこで胃や腸の運動性を制御し、弱体化させます。
SST4 は、Gi タンパク質を介して AC と結合します。 合成由来のアゴニストは知られていますが、その親和性は天然ソマトスタチンの 10 分の 1 です。 これらの受容体の密度が最も高いのは、網膜、胎盤、脳です。 視覚イメージの認識と胎盤の活動の調節におけるそれらの重要な役割は確立されています。
SST5 受容体には 2 つのサブタイプがあります。最初のタイプは、Gi タンパク質を介してアデニル酸シクラーゼと関連します。 2 番目のタイプは、Gs タンパク質を介して FLS C に関連付けられます。 SST は、これらの受容体を介して、血中への下垂体ホルモンの放出と膵臓からのインスリンの放出を阻害します。さらに、血管平滑筋の増殖抑制効果もあります。 血管壁の線維性成長と、これに伴う血管内腔の減少を抑制します。
したがって、CCT-14 と CCT-28 は、受容体タイプ 2 およびタイプ 5 を介して、下垂体ホルモン (ACTH、成長ホルモン、プロラクチン、甲状腺刺激ホルモン、性腺刺激ホルモン) の分泌を阻害します。 受容体タイプ 1 およびタイプ 5 を介して、血液中へのグルカゴンとインスリンの放出を阻害します。

Lacerta Tokyo Сo.,Ltd.
個人情報保護方針
電子メールの不正な収集の拒否
著作権©2016 LACERTA,Inc. すべての権利を保有します。